Kupfer(II) ist bekannt dafür, in vielen Verbindungen grüne oder blaue Farben anzunehmen. In diesen Versuchen sollen daher Verbindungen mit ungewöhnlichen Farben für Kupfer hergestellt werden. Die Komplexe enthalten Cyanursäure bzw. Natriumdichloroisocyanurat, welche beide als Poolzubehör verwendet werden.
Geräte:
Bechergläser, Heizplatte mit Magnetrührer, Waage, Vakuumpumpe + Fritte (alternativ Trichter + Filterpapier)
Chemikalien:
Kupfersulfat Pentahydrat



Kupferacetat Monohydrat



Cyanursäure
Ammoniak (25 %)



Natriumhydroxid

Natriumdichloroisocyanurat Dihydrat




Wasser (demin.)
Diamminkupfer(II)-cyanurat



Triamminkupfer(II)-cyanurat



Tetraamminkupfer(II)-cyanurat



Natriumtetrakisdihydrogencyanuratocuprat(II)



Natriumtetrakisdichloroisocyanuratocuprat(II)



Hinweis:
Natriumdichloroisocyanurat riecht unangenehm nach Chloraminen und entwickelt beim Kontakt mit Säuren giftiges Chlor. Gleiches gilt für seinen Kupferkomplex.
Durchführung:
Diamminbisdihydrogencyanuratokupfer(II):
2,6 g (20 mmol) Cyanursäure werden unter Rühren in 100 mL Wasser unter Erwärmen gelöst. Dazu werden 2 g NH3 (25 %) gegeben. In einem zweiten Becherglas werden 2,5 g (10 mmol) Kupfer(II)-sulfat Pentahydrat in 50 mL kochendem Wasser gelöst. Zu dieser Lösung werden 3,5 g NH3 (25 %) gegeben, was dazu führt, dass sich der Niederschlag fast ganz wieder auflöst. Die Kupferlösung wird unter Rühren in die heiße, aber nicht kochende, Cyanursäure-Lösung gegossen, wobei der Komplex sofort ausfällt. Er wird mit der Fritte abfiltriert, mit etwas Wasser gewaschen, etwas trocken gesaugt und auf Filterpapier auf der Heizung getrocknet.
Ausbeute: 3,039 g (8,6 mmol, 86 % d. Th.) als blassrosa (pfirsichblütenrotes) Pulver.
Triamminbisdihydrogencyanuratokupfer(II):
6 g (17 mmol) des Diammins werden mit 400 ml Wasser versetzt mit 50 g NH3 (25 %, 735 mmol) für eine halbe Stunde unter Rühren gesiedet, dann für fünf Stunden (besser wären einige Tage) stehen gelassen. Während dieser Zeit kristallisiert der Rest des Produktes aus. Der violette Niederschlag wird abfiltriert und auf Filterpapier auf der Heizung getrocknet.
Ausbeute: 4,103 g (11 mmol, 65 % d. Th.)
Tetraamminbisdihydrogencyanuratokupfer(II):
10,3 g (29 mmol) des Diammins werden mit 25 g NH3 (25 %, 368 mmol) übergossen und für fünf Minuten verrührt und alle Klumpen möglichst zerdrückt. Die Farbe geht über ein Violett in ein Blau über. Der Niederschlag wird abgenutscht und für drei bis vier Minuten trocken gezogen, anschließend in Filterpapier und mit Küchenpapier ausgepresst. Der Komplex verliert leicht Ammoniak und riecht stark danach, wodurch Trocknen ohne Zersetzung nicht möglich ist. Bereits nach 30 Minuten an der Luft hat das Salz ganz und gar die blaue Farbe verloren und ist violett gefärbt, weshalb es schnell in ein Vorratsgefäß überführt wird.
Ausbeute: etwa 15 g (39 mmol, 133 % d. Th., keine sinnvolle Angabe)
Natriumtetrakisdihydrogencyanuratocuprat(II):
13 g (100 mmol) Cyanursäure und 3.2 g (80 mmol) NaOH werden in 500 ml Wasser unter Sieden gelöst. Eine zweite Lösung aus 2 g (10 mmol) Kupferacetat Monohydrat in 50 ml lauwarmen Wasser wird vorbereitet. Sobald die Cyanuratlösung klar ist wird sie dazugegeben. Die Lösung verfärbt sich zunächst bläulich und dann violett, wobei Produkt ausfällt. Es wird für fünf Minuten gerührt, der Niederschlag sich absetzen gelassen und heiß filtriert. Aus dem Filtrat scheiden sich farblose Nadeln aus, die mitsamt Mutterlauge verworfen werden. Das Produkt wird auf der Heizung getrocknet.
Ausbeute: 6,093 g (9,8 mmol, 98 % d. Th.)
Natriumtetrakisdichloroisocyanuratocuprat(II):
10,24 g (20 mmol) Natriumdichloroisocyanurat Dihydrat werden in 125 mL Wasser unter Rühren und Erwärmen gelöst. Währenddessen wird eine Lösung von 2,5 g (10 mmol) Kupfer(II)-sulfat Pentahydrat in 25 mL Wasser unter Erwärmen vorbereitet. Sobald die erste Lösung weitesgehend klar ist, wird die Kupfersulfatlösung hineingegeben. Die Lösung färbt sich kurz dunkelblau und dann violett, wobei die Ausscheidung des Produktes beginnt. Die Lösung wird für fünfzehn Minuten gerührt, kurz stehen gelassen, abfiltriert, das Produkt mit etwas Wasser gewaschen und auf der Fritte so trocken wie möglich gesaugt. Anschließend wird auf Filterpapier auf der Heizung getrocknet.
Ausbeute: 8,973 g (8,0 mmol, 80 % d. Th.) als kräftig violettes Pulver.
Entsorgung:
Die Restlösungen in allen Fällen enthalten sehr geringe Mengen Kupfer, sollten aber dennoch in einem Behälter für Kupferabfälle gesammelt werden.
Erklärung:
Diamminbisdihydrogencyanuratokupfer(II) besitzt die Formel [Cu(C3H2N3O3)2(NH3)2] und bildet sich nach folgender Reaktionsgleichung:
Cu2+ + C3H2N3O3- + 2 NH3 → [Cu(C3H2N3O3)2(NH3)2]
Es existieren auch noch das entsprechende Triammin und Tetraammin, welche violett und blau sind.[1] Diese bilden sich wie folgt:
[Cu(C3H2N3O3)2(NH3)2] + NH3 → Cu(C3H2N3O3)2 • 3 NH3
[Cu(C3H2N3O3)2(NH3)2] + 2 NH3 → Cu(C3H2N3O3)2 • 4 NH3
Der Tetraamminkomplex verliert leicht Ammoniak und geht dabei in das Triammin über.
Nach den Auffassungen von Claus und Putensen handelt es sich hierbei um entsprechende Ammoniaksalze, es finde also weitere Deprotonierung der Cyanursäuren statt.[1]
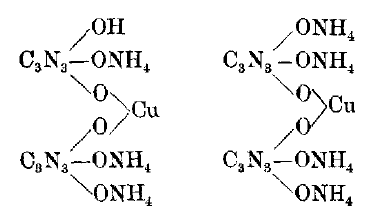
Werner argumentiert dagegen, da entsprechende Verbindungen auch bei Dimethylderivaten der Cyanursäure gefunden wurden (mit der selben, ungewöhnliche Farbe) müsse es sich um Amminkomplexe handeln, wobei das Tetrammin wahrscheinlich als gewöhnliches Tetraamminkupfer(II)-Ion mit Cyanurat als Gegenion vorliegt.[4]
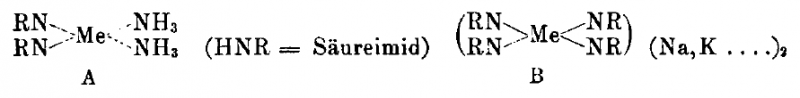
Natriumtetrakisdihydrogencyanuratocuprat(II) wird nach der Vorschrift von Werner dargestellt, wobei ein großer Überschuss an Natriumcyanurat zum Einsatz kommt.[4] Ein Teil kristallisiert davon unverbraucht am Ende aus, weshalb die Lösung heiß filtriert werden muss. Die Bildung findet wie folgt statt:
2 Na+ + 4 C3H2N3O3- + Cu2+ → Na2[Cu(C3H2N3O3)4]
Natriumtetrakisdichloroisocyanuratocuprat(II) besitzt die Formel Na2[Cu(C3N3O3Cl2)4] und bildet sich nach folgender Reaktionsgleichung:
2 Na+ + 4 C3N3O3Cl2- + Cu2+ → Na2[Cu(C3N3O3Cl2)4]
Es werden noch weitere Komplexe beschrieben, zum Beispiel das Nickel(II)-Analog, welches allerdings keine außergewöhnliche Farbe besitzt[2][3]
Bilder:

Diamminbisdihydrogencyanuratokupfer(II) direkt nach dem Ausfällen.

Beim Erhitzen des Diammins mit Ammoniak geht ein Großteil in Lösung, beim Abkühlen fällt die violette Verbindung aus.

Beim Verrühren des Diammins mit konzentriertem Ammoniak färbt es sich blau, das Tetraammin bildet sich.

Frisch gefälltes Natriumtetrakisdihydrogencyanuratocuprat(II).

Natriumtetrakisdichloroisocyanuratocuprat(II) auf der Fritte.

Di-, Tri- und Tetraammin (von links nach rechts) im Vergleich.

Natriumtetrakisdihydrogencyanuratocuprat(II) (links) und Natriumtetrakisdichloroisocyanuratocuprat(II) (rechts) nebeneinander
Quellen:
[1] - Claus, A.d. and Putensen, O. (1888), XI. Beiträge zur kenntniss der cyanursauren Salze. J. Prakt. Chem., 38: 208-229. doi:10.1002/prac.18880380116
[2] - Patent US3055889 "Dichlorocyanurate complex salts", https://patents.google.com/patent/US3055889
[3] - https://woelen.homescience.net/science/ ... /TCCA.html
[4] - Ley, H. and Werner, F. (1913), Salz‐; und Komplexsalz‐;Bildung bei Imidverbindungen. (10. Mitteilung über innere Komplexsalze). Ber. Dtsch. Chem. Ges., 46: 4040-4050. doi:10.1002/cber.191304603203
