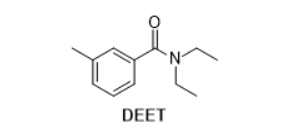
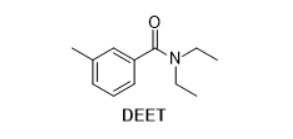
N,N-Diethyltoluamid (DEET) oder auch N,N-Diethyl-3-methylbenzamid ist ein weit verbreitetes Insekten-Abwehrmittel, das z.B. im Produkt Anti-Brumm® enthalten ist. Früher glaubte man, dass DEET bestimmte Duftstoffrezeptoren der Insekten blockieren und dadurch die Wahrnehmung von menschlich abgesonderten Substanzen wie Milchsäure und vor allem 1-Octen-3-ol verhindern würde. Mittlerweile stellte sich zudem heraus, dass DEET, unabhängig davon, eine abstoßende Wirkung besitzt. Der Wirkungsmechanismus ist in seiner Gesamtheit noch nicht komplett aufgeklärt. DEET ist in den entsprechenden Produkten in ethanolischer (ca. 60% EtOH/ 40% Wasser) Lösung enthalten.
Geräte:
Destillationsbrücke, Rundkolben, Heizplatte, Scheidetrichter, Filterzubehör.
Chemikalien:
Mückenabwehrspray mit DEET

Ethylacetat


N,N-Diethyltoluamid

Hinweis:
Obwohl DEET breite Verwendung als Insektenabwehrmittel findet, das von vielen vermutlich auch auf die Haut aufgetragen wird, ist von direktem Kontakt abzuraten. Es können gelegentlich allergische Reaktionen und Augen-/Schleimhautreizung auftreten. Ethylacetat ist leichtentzündlich.
Durchführung:
Der Inhalt des entsprechenden Sprays (hier: 60 mL Flüssigkeit mit 39% DEET) wird in einen Rundkolben überführt und der Hauptteil des Ethanols per Destillation oder am Rotationsverdampfer abgezogen. Nach einiger Zeit sollten sich im Rückstand nach initialer Trübung bereits zwei Phasen gebildet haben. Die abgekühlte Mischung (Sumpf, nicht Destillat) wird in einen Scheidetrichter überführt und mit 2x 25 mL Ethylacetat extrahiert. Die vereinigten organischen Phasen werden über wasserfreiem Natriumsulfat getrocknet. Schließlich wird dieses abfiltriert, wobei als Filtrat eine klare, leicht gelbliche Lösung erhalten wird. Das Ethylacetat wird abgedampft und der viskos-flüssige gelbe Rückstand- das DEET- im Vakuum getrocknet.
Ausbeute: 23,5 mL (97% d.Th.)
Entsorgung:
DEET und Ethylacetat werden beide dem organischen, halogenfreien Abfall zugeführt.
Erklärung:
DEET ist, wie an seiner Struktur zu erkennen ist, ein eher lipophiles Molekül. Im Insektenspray wird es durch das Vorhandensein von Ethanol in Lösung gehalten. Ein direktes Verdünnen des Sprays mit Wasser führt allerdings zu keiner Abtrennung des DEET. Daher wurde der Ethanol destillativ entfernt. Aus wässriger Emulsion kann es schließlich leicht mit Ethylacetat extrahiert werden.
Bilder:

Produkt aus dem DEET extrahiert wurde.

Abtrennung des Ethylacetats.

N,N-Diethyltoluamid.