Geräte:
Brenner, Reagenzglasklammer, Reagenzglas
Chemikalien:
Citronensäure
Polycitrat
Durchführung:
Man gibt ca. 3 g Citronensäure in das Reagenzglas. Dann erhitzt man solange mit dem Brenner, bis man keine Gasentwicklung mehr erkennt. Nach dem Abkühlen erhält man einen sehr viskosen, klebrigen Stoff: Ein Polyester ist entstanden.
Entsorgung:
Das Polycitrat gibt man zu den organischen Abfällen. Das Reagenzglas kommt in den Glasabfall.
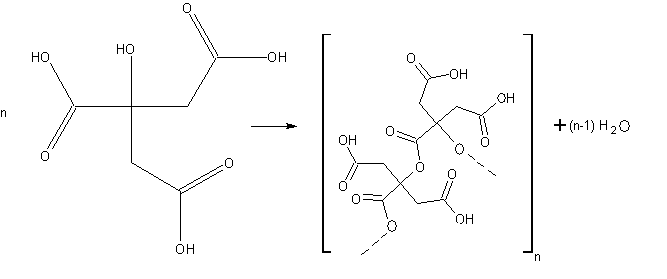
Erklärung:
Es findet eine Veresterung statt. Da die Citronensäure gleichzeitig die Rolle des Alkohols (OH-Gruppe) und die der Carbonsäure (COOH-Gruppe) einnimmt, können sich 2 Citronensäuremoleküle unter Abspaltung von Wasser verbinden. Weil dann immernoch eine der beiden Gruppen frei bleibt, greift die andere Gruppe eines freien Citronensäuremoleküls diese an. Auf diese Weise können sich lange Polyesterketten bilden.
Bilder:

Zitronensäureschmelze

Klare Schmelze; die Gasentwicklung ist gut zu erkennen

Nach dem Abkühlen

Ein Polyesterfaden
