Geräte:
Messbecher 100 ml, 50 ml Becherglas, 150 ml Becherglas, Gaswaschflasche, Erlenmeyerkolben, gerader Vorstoß, Tropftrichter, PVC-Schlauch, Schüssel für Eisbad
Chemikalien:
Natriumhydroxid
Wasserstoffperoxid 30%


Salzsäure 24%

Trichlorisocyanursäure



dest. Wasser
Eis
Hinweis: Bei der Reaktion entsteht sehr giftiges Chlorgas! Es sollte unbedingt unter einem gut ziehenden Abzug oder im Freien gearbeitet werden!
Durchführung:
Zunächst löst man 10 g Natriumhydroxid in 70 ml Wasser in einem 150 ml Becherglas. Diese Lösung sowie 15 ml Wasserstoffperoxid in einem 50 ml Becherglas werden anschließend im Eisbad abgekühlt. Im Erlenmeyerkolben legt man dann ca. 30 g Trichlorisocyanursäure vor, setzt den Vorstoß mit aufgesetztem Schlauch auf und setzt den mit ca. 80 ml Salzsäure befüllten Tropftrichter darauf. Die Apparatur wird an einem Stativ eingespannt. Nun füllt man die Gaswaschflasche mit den gekühlten Lösungen und verschließt diese mit dem Gaseinleitungsrohr, an welches man nachher das andere Schlauchende befestigt. Danach leitet man einen kräftigen Chlorstrom durch die Lösung. Ein rotes Leuchten ist in der Waschflasche erkennbar.
Entsorgung:
Nach ausreichender Lüftung wird die überschüssige Trichlorisocyanursäure neutralisiert und zu den organischen Abfällen gegeben. Die Lösung in der Waschflasche wird neutralisiert und ins Abwasser gegeben.
Erklärung:
Beim Durchleiten von Chlor durch die Hydroxidlösung entsteht zuerst Hypochlorit:
Cl2 + 2 NaOH ---> NaOCl + NaCl + H2O
Dieses reagiert dann mit dem Wasserstoffperoxid zum Chlorperoxidanion (der genaue Mechanismus ist noch nicht geklärt), das anschließend unter Abgabe von Chlorid Sauerstoff bildet:
NaOCl + H2O2 ---> NaOOCl + H2O
NaOOCl ---> 1O2 + NaCl
Im Chlorperoxidion sind zwei der 2p-Orbitale des Sauerstoffs voll besetzt. Wegen dem Spinerhaltungssatz wird nun das Elektron im halbbesetzten Orbital abgegeben, womit der Singulettzustand erhalten wird.
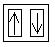
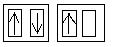 ---->
----> 

 + e-
+ e-2px 2py 2pz (Zustand im Chlorperoxidion)
Anschließend geht der Sauerstoff wieder unter Lichtabgabe in den Grundzustand - den Triplettzustand (Spinquantenzahl: 0,5+0,5+0,5-0,5=1; Multiplizität: 2x1+1=3) - über.

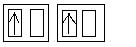
Triplettzustand bei den 2p-Orbitalen
1O2 -- -hv --> 3O2
Bilder:

Apparatur

Chemilumineszenz

Chemilumineszenz (Bild von Cyan)

