Geräte:
Heizpilz, Magnetrührer, Rührfische, Bechergläser, Nutsche, Saugflasche, Filterpapier, Spatel, Zweihalsrundkolben, Stopfen, Rückflusskühler, Gasableitungsrohr, Gaswaschflasche oder ähnliches, Thermometer, Nitrilhandschuhe
Chemikalien:
Chlorsulfonsäure

Acetanilid

Ammoniaklösung


Natriumhydroxid

Aceton


Toluol


Salzsäure, konz.

Ethanol

Natriumhydrogencarbonat
Wasser
Eis
p-Acetamidobenzensulfochlorid

p-Aminosulfonylacetanilid

Sulfanilamid
Hinweis:
Vorsicht beim Arbeiten mit Chlorsulfonsäure! Nitrilhandschuhe und ein gut ziehender Abzug sind bei dieser Synthese unabdingbar.
Durchführung:
Synthese von p-Acetamidobenzensulfochlorid:
In einer Rückflussapparatur werden unter Rühren 13,51 g Acetanilid vorsichtig bei 15°C in 40 mL Chlorsulfonsäure eingetragen. Der entstehende Chlorwasserstoff wird mit einem Gasableitungsrohr in konzentrierte Natronlauge geleitet und somit neutralisiert. Dann erhitzt man für eine Stunde unter Rückfluss. Ist die Reaktion beendet lässt man abkühlen und gibt dann vorsichtig (!) das Gemisch in Eiswasser. Hierbei sollte man besonders aufpassen, da der Überschuss an Chlorsulfonsäure heftig mit dem Wasser reagiert!
Das p-Acetamidobenzensulfochlorid fällt sofort als weißer Niederschlag aus, den man abfiltriert und in möglichst wenig 40°C warmem Aceton löst. Die Lösung stellt man in den Gefrierschrank oder in ein Eisbad, bis -10°C erreicht sind. Die ausgefallenen Kristalle werden abfiltriert und mit eiskaltem Toluol gewaschen.
Synthese von p-Aminosulfonylacetanilid:
Das p-Acetamidobenzensulfochlorid wird in einer Rückflussapparatur mit 70 mL konz. Ammoniaklösung versetzt und für eine halbe Stunde refluxiert. Die entstandene farblöse Lösung wird auf ~ 50 mL eingedampft und abkühlen gelassen. Beim Abkühlen fällt ein weißer Niederschlag von p-Aminosulfonylacetanilid aus. Das Rohprodukt wird in 140 mL einer 50%igen Ethanollösung in der Hitze gelöst und im Kühlschrank wieder ausgefällt. Danach wird es abfiltriert, mit eiskaltem Wasser nachgewaschen und getrocknet.
Synthese von Sulfanilamid:
Das p-Aminosulfonylacetanilid wird zuerst in einem Becherglas mit 200 mL Wasser unter Rühren suspendiert. Dann werden 100 mL konz. Salzsäure hinzugegeben und auf etwa 70 °C erhitzt. Hat sich das p-Aminosulfonylacetanilid vollständig gelöst, wird für 15 Minuten bei 70°C weiter gerührt. Danach lässt man die Lösung auf Raumtemperatur abkühlen. Zu der nun abgekühlten Lösung gibt man soviel festes Natriumhydrogencarbonat, bis die Lösung nicht mehr aufschäumt. Dies entspricht einem pH-Wert von etwa 5. Daraufhin fällt das Sulfanilamid aus, welches man abfiltriert, mit eiskalten Wasser nachwäscht und trocknet.
Ausbeute: 3,4 g (8,66% d.Th.)
Entsorgung:
p-Acetamidosulfonylchlorid, p-Aminosulfonylacetanilid und Sulfanilamid werden zu den organischen Abfällen gegeben. Salzsäure wird mit Natronlauge neutralisiert und verdünnt in den Abfluss gegeben. Überschüssige Chlorsulfonsäure wird mit konzentrierter Schwefelsäure verdünnt, vorsichtig mit Eis hydrolysiert, neutralisiert und ebenfalls verdünnt in den Abfluss gegeben.
Erklärung:
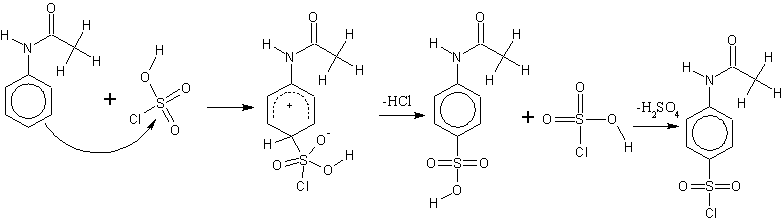
Die Chlorsulfonierung verläuft mit 2 mol Chlorsulfonsäure. Zuerst wird das Acetanilid elektrophil angegriffen, wodurch die Sulfonsäure entsteht. Das zweite Molekül von Chlorsulfonsäure bildet in einem Additions-Eliminierungs-Mechanismus das Sulfochlorid unter Abspaltung von Schwefelsäure.
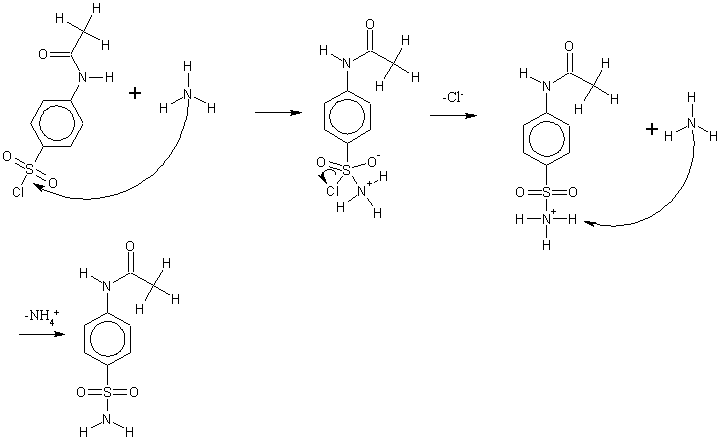
In einer nucleophilen Substitution greift ein Ammoniakmolekül den Schwefel der Sulfochloridgruppe nucleophil an. Ein Chloridion spaltet sich ab. Das resultierende Ammoniumion wird durch ein zweites Molekül Ammoniak deprotoniert. Es entsteht p-Aminosulfonylacetanilid.
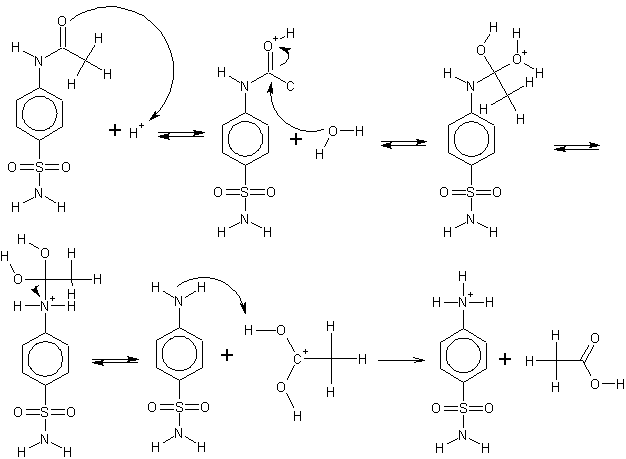
Die Acetylgruppe, welche eigentlich als Schutzgruppe fungiert, wird hydrolisiert. Die Carbonylgruppe wird protoniert. Daraufhin addiert sich Wasser an den aktivierten Carbonylkohlenstoff. Das resultierende Oxoniumion wird neutralisiert. Es wird Essigsäure abgespalten und das Sulfanilamid liegt in wässriger Lösung protoniert vor.
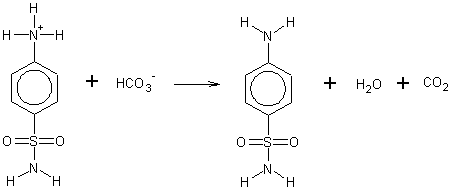
Um das Sulfanilamid auszufällen wird das Natriumhydrogencarbonat hinzugegeben: Im Sinne einer Säure-Base-Reaktion deprotoniert das Hydrogencarbonation das Ammoniumion.
Bilder:

Die Apparatur für die Chlorsulfonierung

Das Acetanilid-Chlorsulfonsäure-Gemisch (die gelbliche Färbung kam leider durch eine Verunreingung vom Rührfisch, hat aber bei der Reaktion nicht gestört, das Gemisch sollte eigentlich farblos sein.)

Das ausgefallene p-Acetamidobenzensulfochlorid

Das abfiltrierte p-Acetamidobenzensulfochlorid

p-Acetamidobenzensulfochlorid wird mit konz. Ammoniaklösung refluxiert

Das Rohprodukt

Beim Umkristallisieren aus 50%igen Ethanol

Das reine p-Aminosulfonylacetanilid

Hydrolyse des p-Aminosulfonylacetanilid

Das fertige Sulfanilamid
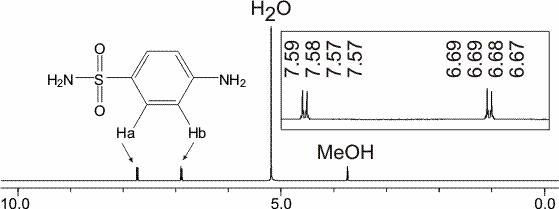
1H-NMR Spektrum vom Sulfanilamid. Gelöst in Methanol-d4.
Zu sehen ist der typische Dacheffekt für ein 1,4-substituiertes Benzen, resultierend aus einer Ha-Ha' / Hb-Hb' Kopplung der aromatischen Protonen. Die Protonen der Sulfamidgruppe resp. der Aminogruppe sind austauschbare Protonen, weswegen sie in dem Spektrum nicht auftauchen.
