Geräte:
Becherglas, Kristallisierschale bzw. Petrischale, Spatel
Chemikalien:
Kaliumpermanganat
Gummibär
Kaliumcarbonat
dest. Wasser
Durchführung:
Zuerst löst man in 500ml Wasser 0,2g Kaliumpermanganat. Dann gibt man 50ml der Lösung in das Becherglas bzw. Kristallisierschale, gibt ca. 0,5g Kaliumcarbonat hinzu und rührt mit dem Spatel, bis sich alles gelöst hat. Danach gibt man das Gummibärchen hinzu, wobei schon kurz danach blaue Schlieren am Gummibärchen entstehen. Zum Ende der Reaktion hat sich die Lösung braun verfärbt.
Entsorgung:
Der Becherglasinhalt wird in die schwermetallhaltigen Abfälle gegeben.
Erklärung:
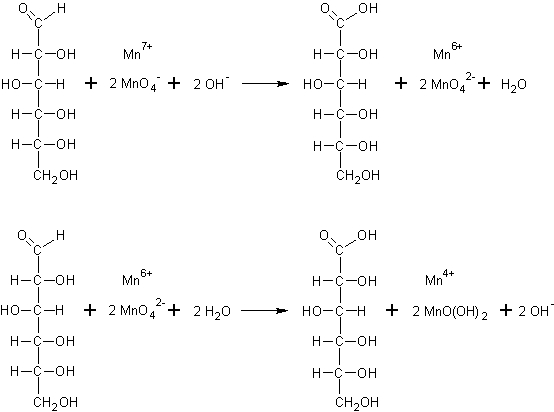
Bei der Reaktion handelt es sich um eine Redoxreaktion.
Die aus den Gummibärchen freigesetzte Glucose reduziert in dem alkalischen Medium die Permanganat-Ionen und wird dabei zur Gluconsäure oxidiert.
Zunächst bilden sich grüne Manganat-Ionen, in denen das Mangan die Oxidationsstufe +VI hat.
In einem weiteren Reaktionsschritt wird das Manganat von der Glucose weiter zum braunen Manganoxidhydroxid (Mangandioxid-Hydrat) reduziert, in dem das Mangan in der Oxidationsstufe +IV vorliegt.
Bilder:
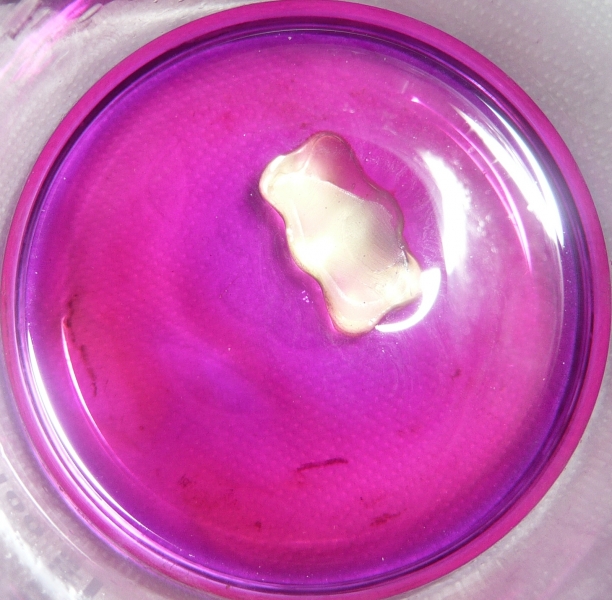
Zu Beginn der Reaktion entstehen am Gummibärchen blaue Schlieren, welche von der Mischfarbe von Violett und Grün herrühren.

Bei fortschreitender Reaktion färbt sich die Lösung durch Manganationen grün (hier schon im Übergang zu braun).

Zum Ende der Reaktion hin färbt sich die Lösung durch Manganoxidhydroxid braun.