Ethylbromid findet Anwendung in Grignard-Reaktionen und wurde früher auch als Narkotikum benutzt.
Geräte:
Waage, Destillationsapparatur (2 Rundkolben von je 100 ml Fassungsvermögen, möglichst langer Kühler und eisgekühlte Vorlage), Spatel, ein trockenes Reagenzglas, Trichter
Chemikalien:
konz. Schwefelsäure

Ethanol

Kaliumbromid
Ethylbromid


Durchführung:
Man baut eine Destillationsapparatur auf. Erhitzt wird mit einem Wasserbad,welches beim Mischen der Edukte gleichfalls zur Kühlung dient. Die Vorlage besteht aus einem 100 ml Rundkolben, der mit 50 ml Wasser beschickt und gut mit Eis gekühlt wird.
Nun legt man 7,5 ml Wasser in den 100 ml Rundkolben vor und gibt 19 ml Schwefelsäure hinzu. Unter leichtem Umschwenken gibt man 20 ml Ethanol vorsichtig hinzu (Gemisch erhitzt sich stark und kann spritzen!). Über einen Pulvertrichter werden dann 11,9 g fein pulverisiertes Kaliumbromid hinzu gegeben. Dieses Gemisch wird nun destilliert. Die Siedetemperatur sollte zwischen 35° und 40°C liegen. Bald sieht man schwere ölige Tropfen von Ethylbromid in der Vorlage zu Boden tropfen. Es wird solange erhitzt bis kein Ethylbromid mehr übergeht (Vorlage beobachten). Nun wird das Ethylbromid in ein trockenes Reagenzglas pipettiert.
Man gibt in etwa die gleiche Menge konz. Schwefelsäure hinzu und schüttelt kräftig. Das Ethylbromid (jetzt die obere Sicht) wird nun mit ein paar Körnchen Calciumchlorid versetzt und erneut destilliert.
Ausbeute: 6 ml (80,3% d.Th.)
Entsorgung:
Der Sumpf wird neutralisiert in den Abfluss gegeben. Das Ethylbromid wird aufbewahrt oder kann mit Natronlauge unter Erhitzen unschädlich gemacht werden.
Erklärung:
Schwefelsäure setzt aus Kaliumbromid Bromwasserstoff frei:
2 KBr + H2SO4 ---> 2 HBr + K2SO4
Dieser reagiert mit Ethanol unter Wasserabspaltung zu Bromethan:
Das Bromidion ist bereits in Lösung vorhanden.
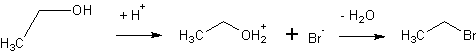

Die Edukte

Das Gemisch

Während der Destillation

Die Vorlage

Der erste Tropfen des Ethylbromids (der milchige Anblick kommt von den unterschiedlichen Brechungsindices von Wasser und Ethylbromid (danke@ cybercop))

Der Sumpf am Ende der Reaktion

Das abgefüllte Ethylbromid
