Dicyano-bis(1,10-phenanthrolinyl)eisen(II) (auch Ferrocyphen) ist ein relativ einfach herzustellender Eisen(II)-komplex, der solvatochrom ist: In unterschiedlichen Lösemitteln zeigt er unterschiedliche Farben. Die Farbe hängt von der Polarität des Lösemittels ab, weshalb dieser Komplex als Indikator für die Polarität von Lösemitteln verwendet werden könnte.
Geräte:
Becherglas, Heizplatte, Glasstab, Spatel, Waage, Apparatur zum Abnutschen, Exsikkator
Chemikalien:
1,10-Phenanthrolin


Eisen(II)-sulfat-Heptahydrat

Kaliumcyanid
Wasser
Hinweis: Kaliumcyanid ist sehr giftig! Kontakt mit Säuren ausschließen, sonst bildet sich äußerst giftiger und flüchtiger Cyanwasserstoff!
Durchführung:
0,30 g Phenanthrolin werden in 100 ml Wasser gegeben und das Gemisch zum Sieden erhitzt, bis sich das Phenanthrolin ganz gelöst hat. Nun gibt man 0,23 g Eisen(II)-sulfat in 5 ml Wasser hinzu, wobei sich die Lösung tiefrot verfärbt. Man erhitzt noch 15 Minuten lang bei gelegentlichem Umrühren und gibt anschließend 0,11 g Kaliumcyanid in 1 ml Wasser hinzu. Man erhitzt noch eine halbe Stunde so, dass die Lösung nicht zu heftig siedet und lässt dann abkühlen. Man lässt das Reaktionsgemisch, welches nun trübe, aber weiterhin dunkelrot ist, über Nacht stehen, nutscht dann die ausgefallenen Kristalle von Dicyano-bis(1,10-phenanthrolinyl)eisen(II) ab und trocknet sie im Exsikkator. Ausbeute: 202 mg (51% d. Th.).
Entsorgung:
Kaliumcyanid wird mit Eisen(II)-sulfat umgesetzt und dann zusammen mit anderen Resten und dem Produkt, falls es nicht aufbewahrt werden soll, zu den anorganischen Abfällen gegeben.
Erklärung:
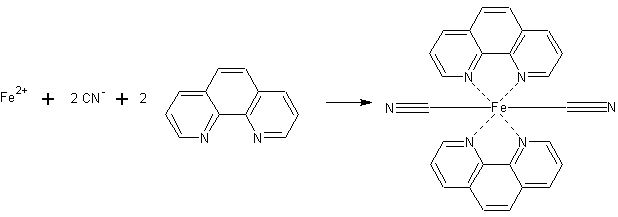
Es bildet sich relativ schwer lösliches Dicyano-bis(1,10-phenanthrolinyl)eisen(II), welches nach einiger Zeit ausfällt:
Bilder:

Lösung von Bis(1,10-phenanthronyl)eisen(II) in Wasser

Lösung von Dicyano-bis(1,10-phenanthrolinyl)eisen(II) in Wasser. Man beachte wie undurchsichtig die Lösung im Vergleich zur Lösung des Bis-(1,10-phenanthronyl)-eisens(II) ist.

Dicyano-bis(1,10-phenanthrolinyl)eisen(II)
