Geräte:
Messbecher, Glasflasche (2000 ml), Reagenzgläser, Glasschale, Rührfisch, Magnetrührer mit Heizfunktion, Ventilator, Backofen, Schläuche
Chemikalien:
Wasser
Ammoniaklösung (25%)


Eisen(III)chlorid-Lösung (40%)

Citronensäure
 Anmerkung: Nach GHS ätzend, nach alter Einstufung Reizend
Anmerkung: Nach GHS ätzend, nach alter Einstufung ReizendSilbernitrat-Lösung


Salpetersäure verdünnt

Durchführung:
In einer 2000 ml Flasche werden 40 g der 40% Eisen(III)chlorid-Lösung in 300 ml Wasser unter rühren in eine Lösung von 25 g Ammoniaklösung (25%) in 1000 ml Wasser gegossen. Es bildet sich sofort ein feiner flockiger brauner Niederschlag. Die Flasche wird auf mindestens 2 L mit destilliertem Wasser aufgefüllt und 5 min gerührt. Danach lässt man den Niederschlag sich absetzen (min. 30 min; je länger desto besser), wobei sich stetig verdichtet. Nun wird mit einem Schlauch der Überstand in der Weise abgezogen, dass man möglichst keinen Niederschlag mitnimmt (Restvolumen waren ca. 800 ml). Die Flasche wird wieder auf 2 L aufgefüllt und 5 min gerührt und nach dem Absetzen der Überstand wieder abgezogen. Dies wird solange gemacht bis der Chloridnachweis (Überstand in einem Reagenzglas mit verd. Salpetersäure ansäuern und mit Silbernitratlösung versetzen) fast negativ ist (nur leichte Trübung) und der Geruch nach Ammoniak verschwunden ist (pH-Wert geht von 8.5 auf 7 zurück). Bei diesem Versuch reichte 5 mal Waschen aus um das Chlorid zum größten Teil zu entfernen. Die ganze Flüssigkeit wird nun in eine hitzefeste Schale gegeben und mit 60 g (ist wahrscheinlich eine zu große Menge vgl. "Anmerkungen") Citronensäure versetzt und erwärmt, dabei löst sich der Niederschlag auf und es entsteht eine rötliche klare Lösung. Mit einem Ventilator wird nun ein stetiger Luftstrom über die Schale geblasen (geht damit schneller) und der Inhalt auf ca. 50% eingedampft. Nach dem Abkühlen wird nun solange 25% Ammoniaklösung zugegeben bis der pH-Wert leicht (7.5 bis 8.5) im alkalischen ist, dabei sollte sich die Farbe der Lösung nach dunkelgrün verändern. Nun kann die Lösung solange eingedampft werden bis eine sirupartige Flüssigkeit entsteht. Die komplette Trocknung erfolgt am besten im Backrohr über Nacht (oder noch länger) was auf ca. 50 bis 60°C erwärmt worden ist.
Entsorgung:
Sämtliche Rückstände können mit Wasser aufgelöst und über die Kanalisation entsorgt werden.
Erklärung:
Aus der Eisen(III)chlorid-Lösung wird durch den Ammoniak Eisen(III)-oxidhydroxid gefällt und dieses durch Zugabe von Citronensäure in Eisen(III)citrat umgewandelt. Da ein Überschuss von Citronensäure eigesetzt wurde, bleibt frei Säure übrig, die im nächsten Schritt mit der Ammoniaklösung neutralisiert wird und dabei Ammoniumcitrat entsteht, zusammen (Eisen(III)citrat + Ammoniumcitrat) ergibt sich das Ammoniumeisen(III)citrat, was selbst kein genau definiertes Salz ist (siehe Anmerkungen).
Anmerkungen:
a) Das Waschen des Niederschlags als Suspension wurde deswegen eingeführt, weil Filtrationsversuche bei diesem Art von Niederschlag meist in sehr zeitintensiven Filter-Orgien ausarten. Meiner Erfahrung nach ist dieser Niederschlag so gut wie nicht filtrierbar, außer man wendet die Leintuchmethode an.
b) Im Handel bekommt man Ammoniumeisen(III)citrat entweder als braunes Produkt mit 18 % Fe oder als grünes mit ca. 14.5-16 % Fe. Wenn bei der Zugabe der Ammoniaklösung die Farbe sich nicht dauerhaft ändert und bei braun bleibt, dann bedeutet dies, dass der Eisengehalt zu hoch ist und man diesen durch weitere Zugabe von Citronensäure und Ammoniaklösung verringern muss. Umgekehrt kann man den Eisengehalt natürlich auch zu gering sein und damit die grüne Farbe zu blass d.h. hier wäre die Zugabe von Eisen(III)citrat nötig, was man sich dann allerdings aus Eisen(III)chlorid über die Fällungsreaktion und dem Waschen des Niederschlages und der Umsetzung mit Citronensäure nochmals herstellen müsste. D.h. lieber etwas weniger Citronensäure zugeben, da sich der Gehalt an Fe. leichter vermindern als erhöhen lässt.
c) Bei der Zugabe der Ammoniak-Lösung verfärbt sich die Eintropfstelle sehr dunkelgrün, die Farbe der Lösung wird immer dunkler je mehr Ammoniak-Lösung zugegeben wird.
d) Es ist vorteilhaft den sirup-artigen Rückstand möglichst dünn in der Schale zu verstreichen, damit er schnell durch trocknet.
e) Eisengehalt: Wie schon angemerkt, hat das mit den obigen Mengen (Citronensäure) hergestellte Produkt wahrscheinlich zu wenig Fe-Gehalt. Bei der Verwendung der Mengen laut "Hagers Handbuch der pharmazeutischen Praxis" erhielt ich ein Produkt was sich bei Zugabe von Ammoniaklösung nicht grün verfärbte.
(50 g 10% Fe-Gehalt (= 29% Eisen(III)chlorid) Lsg. gefällt plus 18.57 g Citronensäure)
Bilder:
Die Ammoniak-Lösung:

Die Eisen(III)chlorid-Lösung:
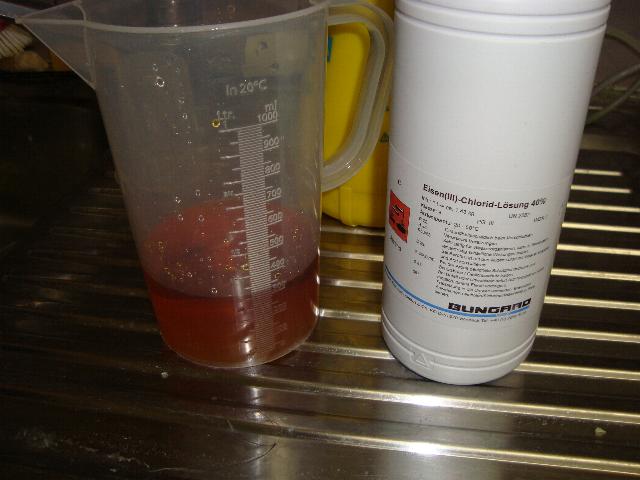
Fällungsreaktion:

Absetzen des Niederschlags:

Nach dem Absaugen des Waschwassers:

Prüfung auf Chlorid:

Citronensäure 60g:

Erwärmen der Lösung:

Klare rote Eisen(III)citrat Lösung (mit Überschuss Citronensäure):

Nach der teilweisen Zugabe der Ammoniak-Lösung:

Endpunkt und beginnendes Eindampfen der Lösung:

Während des Eindampfens:

Sirup-artiger Rückstand:

der langsam immer fester wird:

und dann kristallisiert:

nach dem Trocken kann er gemörsert werden, allerdings zeigen größere Brocken da durchaus noch Restfeuchte:

Ausbeute waren 63.88 g eines blass grünen Pulvers....
Literatur:
Hagers Handbuch der pharmazeutischen Praxis vgl.
a) Liquor Ferri sesquichlorati. Eisenchloridlösung
Der Gehalt betragt nach den meisten Pharm. 29% FeCl3 = 10% Fe
b) Ferrum aceticum siccum
25 T. Wasser wird in eine Mischung von 5 T. Ammoniakflüssigkeit (10% NH3) und 100 T. Wasser unter Umrühren eingegossen. Nach dem Mischen muss die Flüssigkeit Lackmuspapier deutlich blauen, andernfalls ist noch etwas verdünnte Ammoniakflüssigkeit zuzusetzen. Bei richtiger Zusammensetzung der Eisenchlorid-Lösung und richtigem Gehalt der Ammoniakflüssigkeit reicht die angegebene Menge Ammoniak aber aus, da auf 56 T. Eisen nur 51 T. Ammoniak erforderlich sind. Der Niederschlag wird erst durch Abgießen, dann auf einem leinenen Filtertuch mit Wasser solange gewaschen, bis das Waschwasser nach dem Ansäuern mit Salpetersäure durch Silbernitratlösung nicht mehr getrübt wird. Dann wird das Eisenhydroxyd möglichst stark abgepresst.
c) Ferrum citricum ammoniatum viride Grünes Ferri-Ammoniumcitrat
Darstellung: Das frisch gefallte, ausgewaschene und abgepreßte Eisenhydroxyd aus 100 T. Eisenchloridlösung (10% Fe) wird mit 36,25 T. Citronensäure und etwa 40 T. Wasser in Lösung gebracht; die Lösung wird auf etwa 2/3 eingedampft, und mit so viel Ammoniakflüssigkeit (10% NH3) versetzt, bis sie dunkelgrün geworden ist, dann wird die Lösung zur sirup-dicke abgedampft und auf Glasplatten eingetrocknet.
Bj68