Geräte:
500-mL-Dreihalsrundkolben, 250-mL-Dreihalsrundkolben, Rückflusskühler, langes Schliffthermometer, Schliffstopfen, Messzylinder, Waage, Schliffstopfen, Messzylinder, Wasserbad
Chemikalien:
Hydrochinon


Wasserstoffperoxid 12%

Iod


Isopropanol


Essigsäureanhydrid

Schwefelsäure konz.

Zwischenprodukt:
p-Benzochinon


Endprodukt:
1,2,4-Triacetoxybenzol
Hinweis: p-Benzochinon ist blutschädigend und steht im Verdacht Leukämie zu erzeugen! Essigsäureanhydrid bildet gesundheitsschädliche Dämpfe.
Es sollte unter dem Abzug gearbeitet werden, da das giftige p-Benzochinon über die Atemwege aufgenommen werden kann. Das Tragen von Schutzhandschuhen ist beim Arbeiten mit p-Benzochinon, Essigsäureanhydrid und konz. Schwefelsäure empfehlenswert. Es ist keine Resorption des p-Benzochinons über die intakte Haut bekannt, es besteht aber die Gefahr von Fleckenbildung durch das in der Reaktionslösung enthaltene Iod und auch das p-Benzochinon selbst.
Durchführung:
p-Benzochinon
In einem 500-mL-Dreihalskolben mit Rückflusskühler werden 27,52 g Hydrochinon sowie ca. 100 mL Isopropanol vorgelegt. Es we rden 0,295 g Iod zugegeben (laut Literatur sollten 0,15 g verwendet werden) und das Gemisch mit 100 g Wasserstoffperoxid 12 % versetzt. Ein Thermometer wird so in den Kolben eingesetzt, dass es in die Flüssigkeit eintaucht.
Dann wird der Kolbeninhalt auf ca. 80°C erwärmt, bis das Gemisch nach kurzer Zeit von selbst zu sieden beginnt. Hierauf wird die Heizung entfernt und gewartet, bis der Kolbeninhalt auf knapp unter 50 °C abgekühlt ist. Dabei scheiden sich bereits erste Kristalle ab. Der Kolben wird in ein Eisbad gestellt (T bei meinem Versuch 7-8 °C), bis das Thermometer im Kolben ca. 17 °C anzeigt. Dann wird mit Hilfe einer Saugflasche abfiltriert und die bräunlich gefärbten Kristalle mit ca. 80 mL kaltem Isopropanol gewaschen.
Das Produkt wird im Exsikkator über Calciumchlorid getrocknet.
Es wurden 20,10 g (74,4 % d. Th.) feine, gelborangene Kristallnadeln erhalten, welche bei 114,5 °C schmelzen (Lit.: 115,7 °C).
Zur weiteren Aufreinigung kann das Produkt resublimiert werden, darauf wurde jedoch verzichtet, da das Produkt zur weiteren Synthese ausreichend rein sein sollte. (Anmerkung 09.09.2016: Bei längerer Aufbewahrung erfolgte relativ rasch eine dunkle Verfärbung des Produkts, welche vermutlich auf gebildetes Chinhydron zurückzuführen ist, dies ließe sich evtl. durch eine weitere Aufreinigung per Sublimation reduzieren.)
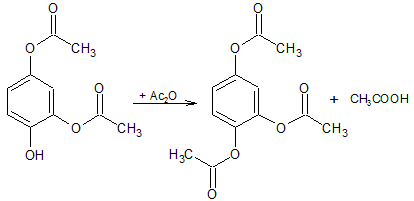
1,2,4-Triacetoxybenzol
In einem 250 mL-Dreihals-Rundkolben werden 48 mL Essigsäureanhydrid vorgelegt und langsam ca. 1,8 mL konz. H2SO4 zugetropft. Dann wird das gepulverte p-Benzochinon (16,0 g) unter Rühren in kleinen Portionen während 15 Minuten zugegeben. Die Temperatur steigt während der Zugabe von 30 °C zu Beginn auf bis zu 50 °C an. Es wird gekühlt, um die Temperatur bei 40-45 °C zu halten. Nach Ende der Zugabe wird für weitere 5 Minuten gerührt und die orangefarbene Lösung dann über 310 g Eis gegossen. Es wird über Nacht stehen gelassen, wobei sich das Produkt langsam absetzt. Anschließend wird mittels einer Saugflasche abfiltriert, mit Wasser gewaschen und aus Ethanol umkristallisiert, beim Waschen des Niederschlags mit Wasser fiel bei meinem Versuch aus dem Filtrat noch eine größere Menge Produkt aus (ca. 1/3 der Gesamtmenge nach Augenmaß). Das Abfiltrieren dieses Niederschlags gestaltete sich als recht schwierig, da er sehr fein war und so als gelartige Masse auf dem Filter lag, gelang aber letztendlich mit viel Geduld.
Ausbeute: 35,0 g (93,8 % der Theorie).
Entsorgung:
Die iodhaltige Reaktionslösung aus dem ersten Schritt wird so lange mit Natriumthiosulfat versetzt, bis eine vollständige Entfärbung eintritt. Anschließend wird mit Natriumhydrogencarbonat neutralisiert und die Lösung verdünnt in den Ausguss gegeben. Das p-Benzochinon wird entweder aufbewahrt oder zu den organischen Feststoffabfällen gegeben. Die Reaktionslösung aus dem zweiten Schritt wird verdünnt in den Ausguss gegeben. Das 1,2,4-Triacetoxybenzol wird entweder aufbewahrt oder zu den organischen Feststoffabfällen gegeben.
Erklärung:
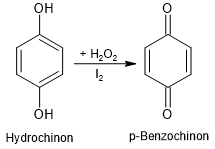
Das Hydrochinon wird durch das Wasserstoffperoxid zum Benzochinon oxidiert. Dabei fungiert Iod als Katalysator.
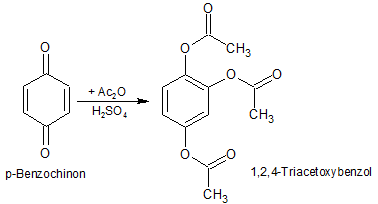
Das Benzochinon wird durch das Essigsäureanhydrid mit Schwefelsäure als Katalysator verestert, sowie in Position 3 acetoxyliert. Diese Reaktion wird auch als Thiele-Winter-Acetylierung oder Thiele-Acetoxylierung bezeichnet.
Reaktionsmechanismus:
1. Protonierung des Essigsäureanhydrids
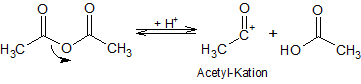
2. Veresterung durch das Acetylkation und nucleophiler Angriff des Acetanhydrids
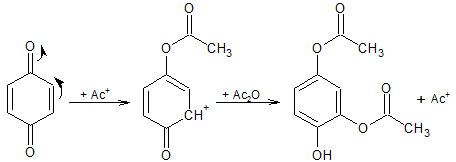
3. Veresterung der verbleibenden Hydroxygruppe durch Acetanhydrid
Bilder:

Reaktionsgemisch aus der ersten Reaktion zu Beginn ...

... während der Reaktion ...

... und beim Abkühlen. Es fallen bereits erste Kristalle aus.

Rohes p-Benzochinon im Büchnertrichter

Das p-Benzochinon nach dem Waschen

Gepulvertes p-Benzochinon für die zweite Reaktion

Reaktionsgemisch des zweiten Schrittes während ...

... und nach Ende der Reaktion.

Es wird über Eis gegossen ...

... und das Produkt scheidet sich ab.

Abfiltriertes 1,2,4-Triacetoxybenzol

Nach dem Umkristallisieren (nur der später noch ausgefallene Teil)
Analytik
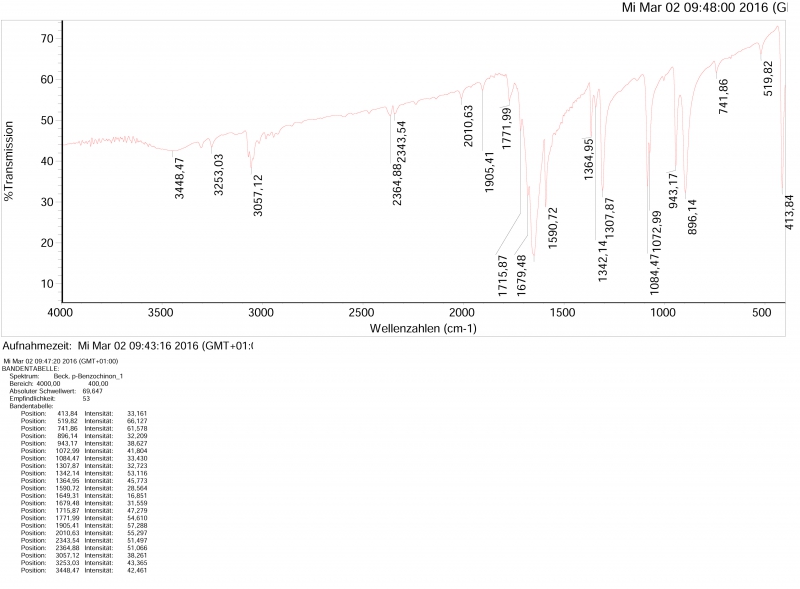
IR-Spektrum des p-Benzochinons (KBr-Pressling), entspricht nahezu vollständig dem Spektrum aus der Datenbank (SDBS des AIST), einzig der Peak ganz rechts kommt im Datenbank-Spektrum nicht vor.
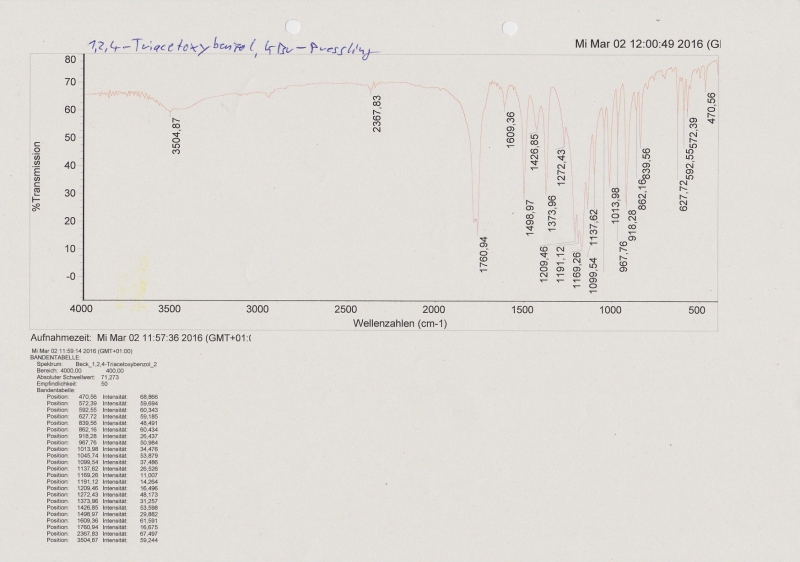
IR-Spektrum des 1,2,4-Triacetoxybenzols (KBr-Pressling), entspricht dem Datenbank-Spektrum, nur die OH-Bande ist deutlich schwächer ausgeprägt.

DC des 1,2,4-Triacetoxybenzols. In der Mitte ist p-Benzochinon als Vergleich aufgetragen. Die Detektion erfolgte in der Iodkammer.
Quellen:
Vorschrift-Lambdasyn
Sicherheitsdatenblatt: p-Benzochinon
McOmie, J. F. W. and Blatchly, J. M. 2011. The Thiele-Winter Acetoxylation of Quinones. Organic Reactions. 19:3:199–277.
K.W. Merz, W. Hagemann, Archiv der Pharmazie 1944, Vol. 282, 79-91
V.K. Ahluwialia, Pooja Bhagat, Renu Aggarwal, Ramesh Chandra, Intermediates for Organic Synthesis, 2005, p. 20
Wikipedia - 1,4-Benzochinon