(Chrysomidazol, Lophin V)
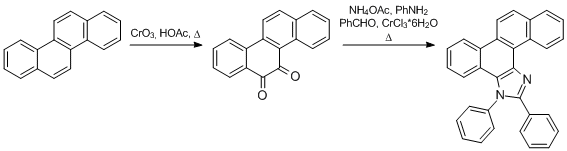
Da Imidazole und dessen Derivate in der Medizin eine wichtige Rolle spielen sind mittlerweile viele einfache Reaktionen bekannt mit denen sich schnell und leicht komplexe Imidazole aufbauen lassen. Ein Beispiel dafür wird hier gezeigt. Da der Name 12,13-diphenyl-13H-chryseno[5,6-d]imidazol recht kompliziert ist, wurde für die Substanz der einfachere Name "Chrysomidazol" vergeben.
Geräte:
Schlenkrohre oder 25 mL Kolben, Magnetheizrührer mit Ölbad, Möglichkeit zur Vakuumfiltration, Trockenschrank (optional)
Chemikalien:
Chrysen


Eisessig

Chrom(VI)-oxid
Anilin
Benzaldehyd
Ammoniumacetat
Chrom(III)-chlorid Hexahydrat

Aceton
Chrysochinon

Chrysomidazol
Hinweis: Chrom(VI)-Verbindungen sind carcinogen und Chrysen steht im Verdacht ebenfalls carcinogen zu sein.
Durchführung:
Chrysochinon:
In einem Reaktionsgefäß werden 0,5 g Chrysen in 10 mL Essigsäure vorgelegt und auf 110 °C erhitzt. Anschließend werden in kleinen Portionen 0,75 g Chrom(VI)-oxid zugegeben, was etwas 2 h in Anspruch nimmt. Die Reaktionsmischung wird anschließend in 150 mL destilliertes Wasser gegeben, abgesaugt, mit siedendem Wasser gewaschen und im Trockenschrank bei 110 °C getrocknet. Das Produkt wird ohne weitere Reinigung für den nachfolgenden Schritt verwendet. Eine Reinigung ist säulenchromatographisch möglich (n-Hexan/Ethylacetat 4:1), das Nebenprodukt ist vermutlich die Di-Säure, die durch weitere Oxidation des Chrysochinons entsteht. Um das Chrysochinon von verbleibenden Spuren von Chrysen zu befreien kann es in konzentrierter Schwefelsäure gelöst und filtriert werden, durch Eingießen in Wasser fällt das Chrysochinon unverändert aus.
Ausbeute: 400 mg (70 % d.Th.) orangefarbenes Pulver
Chrysomidazol:
In einem geschlossenem Reaktiongefäß werden 260 mg Chrysochinon, 80 mg Ammoniumacetat (1 eq.), 93 mg Anilin (1 eq.), 106 mg Benzaldehyd (1 eq.) und 13 mg Chrom(III)-chlorid-Hexahydrat (5 mol%) vermischt und unter Rühren 2 Stunden auf 120 °C erhitzt. Anschließend werden 10 mL Aceton und ein paar Tropfen Wasser hinzugegeben und die Lösung gerührt, bis sich eine Suspension gebildet hat, welche filtriert wird. Der Filterkuchen wird in 20 mL Aceton/Wasser (10:1) aufgekocht und über Nacht stehen gelassen. Das Rohprodukt ist ein Gemisch aus 2 stark fluoreszierenden Verbindungen, welche die Isomere des Chrysomidazols darstellen, wobei das gewünschte Produkt überwiegt. Das Rohprodukt wird säulenchromatographisch (Dichlormethan) gereinigt und kristallisiert in feinen, fast farblosen Fasern.
Ausbeute nach der Säulenchromatographie: 51 mg (es wurde nur ein Teil des Rohproduktes gesäult)
Entsorgung:
Das chromhaltige Waschwasser wird dem Schwermetallabfall zugeführt. Die Lösungsmittel werden wenn möglich recycelt oder dem entsprechenden Lösungsmittelabfall zugeführt. Das Produkt wird aufbewahrt oder dem organischen Feststoffabfall zugeführt.
Erklärung:
Chrysen verfügt aufgrund seiner nicht-linearen Struktur, ähnlich dem Phenanthren, über eine olefinische Doppelbindung, welche durch Oxidationsmittel wie Chrom(VI)-oxid zu einem α,β-Diketon umgesetzt werden kann. Anschließend folgt eine lösungsmittelfreie Reaktion, bei der der Imidazolring aufgebaut wird. Da Chrysochinon ein asymmetrisches Diketon ist sind hier auch grundsätzlich zwei Isomere möglich, wobei das Zielprodukt überwiegt, da die Bildung des anderen Isomers durch eine Verformung des Chrysen- und Imidazolrings sterisch gehemmt ist. Diese Reaktion lässt sich durch viele Verbindungen katalysieren, wobei Chrom(III)-chlorid durch seine einfache Beschaffung und den günstigen Preis besticht.
Darüber hinaus eignet sich diese Methode um vielfältige weitere Imidazole zu synthetisieren, bei denen analog verfahren wird und die nach einem Umkristallisieren aus Aceton/Wasser in hoher Reinheit erhalten werden, wobei unter Verwendung von 2 eq. Ammoniumacetat und ohne aromatische Amine ein Imidazol gebildet wird. Letzteres kann genutzt werden um Lophin in hoher Reinheit zu gewinnen. So wurden mit dieser Vorschrift weitere Imidazole synthetisiert:
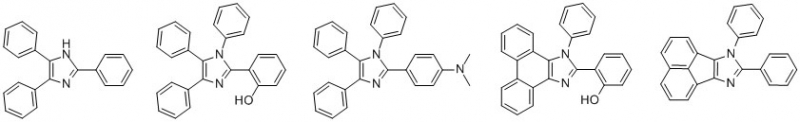
(v.l.n.r: Lophin I, II, III, IV und VI)
Dabei ist bei größeren Ansätzen die Zahl der Nebenprodukte geringer, da die stöchiometrischen Verhältnisse genau stimmen müssen um ausschließlich das Zielprodukt zu bilden. Daher ist es bei den kleineren Ansätzen für das Chrysochinon- und Acenaphthenchinon-Derivat nicht verwunderlich, dass der Anteil der Nebenprodukte ausgeprägter ist. Eine säulenchromatographische Reinigung ist daher bei kleineren Ansätzen oder asymmetrischen Diketonen sinnvoll.
Bilder:

Reaktionsmischung nach Zugabe einer Teilmenge des Chrom(VI)-oxids

Nach beendeter Reaktion ist eine Lösung entstanden

Ausfallendes Chrysochinon

Chrysochinon

Chrysochinon löst sich in konzentrierter Schwefelsäure unter Bildung einer blauen Lösung

Nach Zugabe des Acetons zur dunklen Reaktionsmischung bildet sich ein Niederschlag (hier am Beispiel des Acenaphthen-Derivates, Lophin VI)

Reines Chrysomidazol

Reines Chrysomidazol unter UV-Licht, wobei die leichte blaue Fluoreszenz nicht gut zu erkennen ist.

Übersicht über alle Syntheseprodukte (Lophin I bis VI)

Syntheseprodukte unter UV-Licht (die beiden rechts enthalten noch Verunreinigungen)
Quellen:
C. Liebermann - Ueber Chrysen, Justus Liebigs Annalen der Chemie, 1871, 158, 3, 299–315
Bahador Karami, Khalil Eskandari, Mahnaz Farahi and Akram Barmas - An Effective and New Method for the Synthesis of Polysubstituted Imidazoles by the Use of CrCl3*6H2O as a Green and Reusable Catalyst: Synthesis of Some Novel Imidazole Derivatives, J. Chin. Chem. Soc. 2012, 59, 473-479