Der wohl bekannteste Weg zu einer Aminogruppe ist die Nitrierung eines Kohlenwasserstoffes und anschließende Reduktion. Reaktive Aromaten wie Phenole und Naphthole können aber auch über Nitrosierung und anschließende Reduktion mit Hydrogensulfit in wässriger Lösung reduziert werden.
Geräte:
800 mL Becherglas, 600 mL Becherglas, Eisbad, diverse Löffelspatel, Tropftrichter, Thermometer, Magnetrührer, Magnetrührstäbchen, Filterpapier, Nutsche/Trichter, Exsikkator, Trockenmittel, Schutzbrille, Kittel, Nitrilhandschuhe
Chemikalien:
2-Naphthol

Natriumdisulfit
rauchende Salzsäure 37%

Natriumhydroxid
Natriumnitrit
konzentrierte Schwefelsäure 96%

Natriumchlorid
Eis
1-Amino-2-naphthol

Hinweis:
Das Zwischenprodukt 1-Nitroso-2-naphthol kann starke Hautreizungen hervorrufen!
Durchführung:
14,4 g 2-Naphthol werden mit einer wässrigen Lösung von 4,1 g Natriumhydroxid in 450 mL Wasser unter Rühren gelöst. Danach gibt man 7 g Natriumnitrit hinzu und stellt das Gemisch in das Eisbad. Innerhalb von 5 Stunden werden nun unter starken Rühren 6,5 mL Schwefelsäure zusammen mit 100 g Eis hinzugegeben. Dabei muss darauf geachtet werden, dass das Gemisch sich nicht über 10°C erwärmt. Die Naphtholatlösung färbt sich mit zunehmender Schwefelsäurekonzentration orangegelblich und zum Schluss hat man eine Aufschlämmung des Nitrosonaphthols.
Nach Ablauf der Zeit saugt man das 1-Nitroso-2-naphthol ab und überführt es, nachdem man es mit 10%iger Natriumchloridlösung gewaschen hat, in ein 600 mL-Becherglas. Zu dem Naphthol werden 110 mL Wasser gefolgt von 30 g Natriumdisulfit gegeben. Danach erwärmt man das Gemisch auf 50°C, gibt 60 mL Salzsäure hinzu und lässt noch für 2 Stunden weiterrühren. Dabei wird das orangefarbene Nitrosonaphthol in Lösung zuerst bräunlich, dann färbt es sich bis hin zu einem schwarzen Farbton.
Man lässt einen Tag stehen um die Abscheidung des Produktes zu vervollständigen. Dabei scheidet sich das 1-Amino-2-naphthol als violetter Niederschlag am Boden ab. Man saugt ab und wäscht den Niederschlag mit viel kaltem Wasser. Danach trocknet man im Exsikkator über Calciumchlorid.
Ausbeute: 9,8g (61,6% d.Th.)
Entsorgung:
Das Produkt und alle Überreste davon kommen in den organischen Abfall. Salzsäure, Natriumhydroxid und Schwefelsäure können nach Neutralisation in den Abfluss gegeben werden. Natriumnitrit und Natriumdisulfit können zu den anorganischen Abfällen gegeben werden.
Erklärung:
Es bilden sich elektrophile Nitrosylkationen:
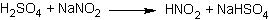
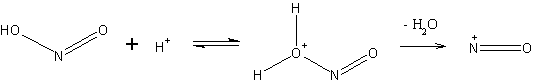
Diese nitrosieren 2-Naphthol:

Disulfit hydrolysiert in einer Gleichgewichtsreaktion mit Wasser zu Hydrogensulfitionen:
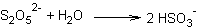
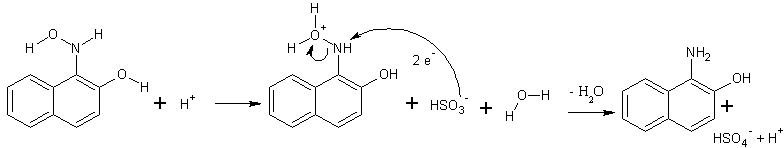
Die Bildung des Hydroxylamins:
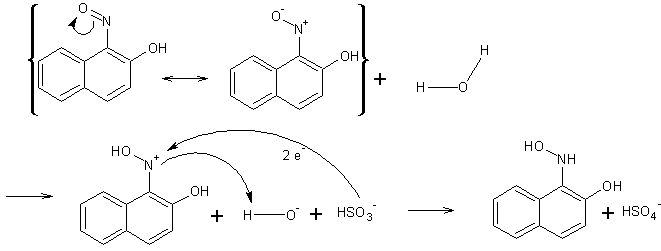
Reduktion des Hydroxylamins zur Aminogruppe:
Bilder:

Die alkalische Naphtholatlösung

Nach einer Stunde im Eisbad, die Lösung färbt sich gelblich.

Nach 5 Stunden ist so viel Nitrosonaphthol enstanden, dass eine Aufschlämmung ensteht.

Reduktion durch die Disulfitlösung - Dunkelfärbung der Lösung...

...bis hin zur Schwarzfärbung.

Am nächsten Tag ist 1-Amino-2-naphthol ausgefallen.

Das abgefüllte 1-Amino-2-naphthol
